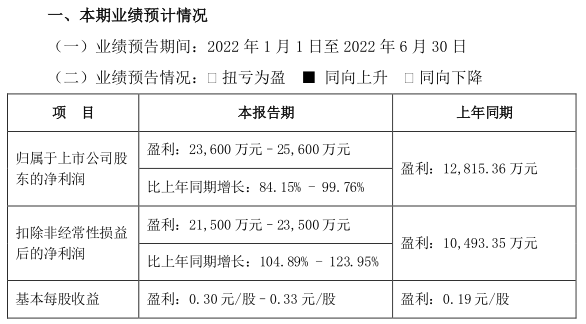
优先审批、时限压缩!吉林省第二类医疗器械审批迎来重大利好
来源:东方财富 发布时间:2022-06-29 08:36 作者:东方财富 阅读量:6883
创新产品注册审批,重点关注四个方面。
此次发布的《吉林省第二类创新医疗器械产品注册审批程序》明确了吉林省第二类创新医疗器械产品注册审批的范围,程序和时限要求,整体压缩办理时限50%以上。
在创新产品的审批程序中,省内第二类医疗器械注册申请适用创新产品注册程序的条件将集中在四个方面:
第一,拥有核心技术通过其主导的技术创新活动,申请人依法在中国拥有核心技术发明专利权
第二,产品基本定型申请人已完成产品的前期研究,基本定型研究过程真实可控,研究数据完整可追溯
第三,产品国内首创产品的主要工作原理或机理为国内首创与同类产品相比,产品的性能或安全性得到根本性的提高该技术处于国际领先水平,具有显著的临床应用价值
第四,技术国内领先医疗器械技术国内领先,填补吉林省空白
四类产品可申请优先审批。
《吉林省第二类医疗器械优先审批程序》对吉林省第二类医疗器械优先审批程序做了具体规定,明确了四类医疗器械产品可以申请优先审批:
一是创新科技成果需要转化为医疗器械将列入国家,吉林省科技重大专项,重点R&D计划或吉林省科技专项,科技创新行动计划,省政府推进重大项目,工业和信息化部或吉林省专,特,新和小巨人企业为其核心竞争力的医疗器械主导产品线纳入优先审批范围
二是满足临床急需,具有明显临床优势的医疗器械可诊断或治疗罕见疾病和恶性肿瘤,临床优势明显或者对老年人特定的,多发性的疾病进行诊断和治疗,目前还没有有效的诊断或治疗方法专门用于儿童且具有明显临床优势的医疗器械将临床急需且未与吉林省同品种产品注册的医疗器械纳入优先审批范围
三是已被国家医药产品管理局医疗器械技术审评中心列入医疗器械优先审批程序并确认属于我国第二类的医疗器械。
产品符合国家或省行业发展规划的医疗器械生产企业凭注册产品迁入本省安全性和有效性已经过验证的外省医疗器械将被优先批准
开通应急审批通道,促进医疗器械快速上市
吉林省第二类医疗器械应急审批程序包括申请范围,审批流程,工作职责和事中事后监管四个方面吉林省二类医疗器械的应急审批做出了具体规定,提供了基本遵循
首先,快速启动当有突发公共卫生事件威胁时,以及突发公共卫生事件发生后,省美国食品药品监督管理局制定并动态调整《吉林省第二类医疗器械应急审批目录》,开通应急审批通道应急审批程序启动后,按照统一指挥,提前介入,现场审查,科学审批的原则,加快产品检验,现场检查,技术审评和行政审批等工作,推进医疗器械应急注册快速上市
第二,同步受理对于应急医疗器械,申请人在申请产品注册时可同步进行产品检验和申请生产许可,省级美国食品药品监督管理局将同步进行医疗器械产品检验,系统验证和技术审评
三优先检查申请人委托省级医疗器械检验所进行检验的,省级医疗器械检验所应当在收到样品后24小时内组织医疗器械检验,并及时出具检验报告
四优先系统验证省级美国食品药品监督管理局应在2日内组织注册质量管理体系验证,必要时根据情况和风险判断,覆盖或优化现场检查
五,优先审查和批准省级美国食品药品监督管理局将在5个工作日内完成技术审查,2个工作日内完成行政审批,并在当天送达申请人
六,同步认证省级美国食品药品监督管理局将生产许可证检查与注册系统核查相结合,医疗器械注册证和生产许可证同时发放
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。
站点精选
- 孙峻任黄山旅游总裁
- 去哪儿:迪士尼搜索热度瞬时增380%带动上海
- 昌红科技收关注函要求说明调低业绩考核指标的原
- 工信部:今年前五个月电信业务收入同比增8.5
- 祁连山部分景区恢复开放推7条旅游路线
- 深圳智能网联汽车管理条例获通过:支持L3无人
- 日本:因工作罹患抑郁症等精神障碍的工伤数连续
- B站“电视大会员”改名“超级大会员”
- 旭辉使用信用保护工具完成发行5亿公司债,票面
- IDC发布中国数据治理报告亿信华辰第一
- 深城交:高度重视有关智能交通展会一般公司会在
- 苹果iPhone14ProMax全新古铜色版
- 国网黄梅县供电公司开展“主任月月讲”安全送基
- 宝馨科技录得6天4板
- 前海深港青年梦工场被认定为首批深圳市港澳青年
- “抢46万的车竟把服务器抢崩溃”!超级赛道股